Artigos
Psicanálise da viabilidade: por que Caiado e o PSD mudam o jogo de 2026
Multimídia
Apesar de críticas, novo Sedur defende agilidade para avanços em Salvador
Entrevistas
Afonso Florence garante candidatura de Lula em 2026 e crava retorno ao Congresso: “Sou parlamentar”
anvisa
A Agência Nacional de Vigilância Sanitária (Anvisa) emitiu nesta segunda-feira (9) um alerta sobre os riscos do uso indevido de canetas emagrecedoras, medicamentos agonistas do receptor GLP?1. O grupo inclui a dulaglutida, a liraglutida, a semaglutida e a tirzepatida.
Em nota, a Anvisa destacou que, embora o risco conste das bulas dos medicamentos aprovados no Brasil, as notificações têm aumentado tanto no cenário internacional como no cenário nacional, o que exige reforço das orientações de segurança.
“Conhecidos popularmente como canetas emagrecedoras, esses medicamentos devem ser utilizados exclusivamente conforme as indicações aprovadas em bula e sob prescrição e acompanhamento de profissional habilitado”, destacou a agência.
O monitoramento médico, segundo a Anvisa, é motivado pelo risco de eventos adversos graves, incluindo pancreatite aguda, que podem incluir formas necrotizantes e fatais.
“Apesar do alerta, não houve mudança na relação de risco e eficácia dessas substâncias. Ou seja, os benefícios terapêuticos ainda superam os efeitos adversos, de acordo com as indicações e modos de uso aprovados e constantes da bula”, completou a agência.
O comunicado cita que, no início do mês, a Agência Reguladora de Medicamentos e Produtos de Saúde (MHRA) do Reino Unido emitiu alerta para o risco, ainda que pequeno, de casos de pancreatite aguda grave em pacientes que utilizam canetas emagrecedoras.
Produção de Mounjaro no Brasil? Projeto busca quebrar patente do medicamento e garantir uso pelo SUS
O Mounjaro, que auxilia pacientes no controle glicêmico e na perda de peso, pode ter a sua patente suspensa no Brasil. Além disso, o medicamento pode vir a ser produzido no país, assim como passar a fazer parte de tratamentos de obesidade pelo Sistema Único de Saúde (SUS).
É o que prevê o PL 160/2026, protocolado nesta semana no Senado. A proposta, apresentada pela senadora Dra. Eudócia (PL-AL), propõe o licenciamento compulsório (suspensão temporária de patentes por interesse público) do medicamento tirzepatida, conhecido comercialmente como Mounjaro.
Na justificativa da sua proposta, a senadora alagoana - que é formada em medicina, com especialização em gastroenterologia pediátrica - argumenta que a obesidade configura-se atualmente como um grave problema de saúde pública no Brasil, com impacto direto sobre a mortalidade, qualidade de vida e custos ao sistema de saúde.
Dra. Eudócia apresenta em seu projeto dados nacionais que mostram que cerca de um terço da população adulta é obesa, com maioria da população tendo excesso de peso, além de aumento de casos entre crianças e adolescentes.
Nesse contexto do aumento crescente da obesidade, a parlamentar defende que medicamentos inovadores como o Mounjaro surgiram como “uma esperança” no controle da obesidade. A senadora diz ainda que os efeitos do medicamento demonstram eficácia significativa no tratamento da obesidade, mas seu alto custo e barreiras de acesso limitam seu uso amplo no país.
“Diante desse quadro, a adoção de licenciamento compulsório, prevista na legislação nacional e em acordos internacionais (como a Declaração de Doha sobre TRIPS), é um instrumento legítimo para permitir a produção local, baixar o preço e ampliar o acesso à população que necessita, promovendo equidade em saúde”, defende a senadora Dra. Eudócia.
O texto do projeto estabelece que poderá ser concedida licença compulsória do remédio, de forma temporária e não exclusiva, conforme o artigo 71 da Lei de Propriedade Industrial. Na prática, essa licença permitirá que o poder público ou empresas autorizadas produzam o medicamento no país, desde que cumpram as normas sanitárias e regulatórias.
Essa licença compulsória, caso o projeto seja aprovado e posteriormente sancionado, poderá ser adotada quando houver comprovação de insuficiência de oferta do medicamento, preços elevados e impacto relevante na saúde pública. A decisão dependeria de análise técnica da Agência Nacional de Vigilância Sanitária (Anvisa).
Dra. Eudócia, na proposta, cita casos em que o Brasil já adotou esse tipo de licenciamento compulsório para facilitar o acesso da população a medicamentos. Em 2007, por exemplo, o governo federal concedeu uma licença compulsória para o remédio para HIV/Aids Efavirenz, após tentar, sem sucesso, reduzir o preço junto à fabricante.
O mecanismo do licenciamento compulsório também foi permitido na pandemia do coronavírus. Em 2021, o Congresso Nacional aprovou autorização para o governo brasileiro decretar licença compulsória temporária de patente de vacinas, testes de diagnóstico e medicamentos para o enfrentamento da covid-19, lembra a senadora.
O Mounjaro (tirzepatida), que a senadora alagoana busca permitir a fabricação no Brasil, é um medicamento injetável aprovado recentemente pela Anvisa. O medicamento chegou ao Brasil com preços variando de aproximadamente R$ 1.400 a mais de R$ 2.300 por caixa, dependendo da dosagem (2,5 mg a 15 mg) e do local de compra.
Protocolado nesta semana, o PL 160/2026 está na Mesa Diretora do Senado, aguardando decisão do presidente Davi Alcolumbre (União-AP) para ser distribuído às comissões onde será discutido e votado.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou a apreensão e proibição do Tirzepatida das marcas Synedica e TG. A medida publicada nesta quarta-feira (21), contempla também o Retatrutida de todas as marcas e lotes.
De acordo com a entidade,com a norma, estes produtos não podem ser comercializados, distribuídos, fabricados, importados, divulgados e usados.Os itens foram fabricados por empresas desconhecidas e estão sendo anunciados e vendidos através de perfis no Instagram sem registro, notificação ou cadastro na Anvisa.
O órgão informou ainda que os produtos não devem ser usados em nenhuma hipótese. Os profissionais de saúde ou pacientes que identificarem os produtos das marcas e lote citados, podem entrar em contato com a Agência, pelos Canais de Atendimento, ou com a Vigilância Sanitária (Visa) local, por meio dos canais disponíveis para consulta no portal da Anvisa.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou a proibição e o recolhimento de todos os lotes do cosmético Serum Facial Uniformizador TXA, Adah Beauty, fabricado pela empresa HF Indústria e Comércio de Cosméticos Ltda. A medida abrange a fabricação, comercialização, distribuição, propaganda e uso do produto.
Segundo a Anvisa, a decisão foi tomada após a constatação de irregularidades no processo de regularização do cosmético. O produto apresentava indicação terapêutica, o que não é permitido para itens classificados como cosméticos.
A agência também adotou medidas contra a empresa RS de Vargas Cosméticos, que teve quatro linhas de produtos proibidas e determinadas para recolhimento por falta de registro sanitário. Assim como no outro caso, ficam vetadas a fabricação, comercialização, distribuição, propaganda e uso dos produtos.
Confira os itens considerados irregulares:
- Realinhamento dos Fios Maxx Liss – Legemaxx Professional;
- Realinhamento dos Fios Perfecta Liss – Legemaxx Professional;
- Power Whey – Helen Zamprogno Beauty Hair;
- Retexturizador Capilar Biotina Supreme Evolution – Eliete Vacari Cosméticos Profissionais.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou, nesta terça-feira (23), a proibição do comércio de todos os medicamentos das marcas Bwell e Needs, ofertados pela empresa Raia Drogasil S.A. A medida estabelece ainda a propaganda e veiculação desses produtos vendidos nos sites drogasil.com.br e drogaraia.com.br.
Segundo a entidade, a organização não possui autorização para produzir os medicamentos. A decisão se estende e se aplica também a qualquer pessoa física, jurídica ou veículo de comunicação que comercialize ou divulgue esses produtos.
Além disso, a Anvisa também proibiu o comércio, a distribuição e o uso dos produtos da marca “Solubrillho Soluções de Limpeza”. A determinação faz referência a todos os lotes produzidos até 14/4/2024.
Segundo a Anvisa, a empresa fabricante é desconhecida, sem CNPJ informado e sem autorização de funcionamento, situação que infringe artigos da Lei 6.360/1976 e da Lei 9.782/1999.
A Bahia registrou 2.859 falhas na assistência à saúde em crianças de 0 a 11 anos, entre 1º de janeiro e 14 de dezembro de 2025. Os dados da Agência Nacional de Vigilância Sanitária (ANVISA), foram compilados e divulgados pela Sociedade Brasileira para a Qualidade do Cuidado e Segurança do Paciente (SOBRASP).
A nível nacional no mesmo período foram notificados no Brasil 459.746 eventos adversos e falhas na assistência à saúde em serviços públicos e privados. Desse total, 47.853 ocorrências envolveram o público de 0 a 11 anos. Já no ano passado, foram obtidos 43.944 eventos adversos nessa mesma faixa etária.
Ainda na Bahia, as faixas de 29 dias a 1 ano, 2 a 4 anos e 5 a 11 anos, notificaram os respectivos números: 837, 987, 424 e 611. Segundo a SOBRASP, os números revelam um cenário preocupante para os pacientes mais vulneráveis: as crianças.
Nos hospitais, as principais causas relacionadas aos eventos adversos, envolvendo esse público, são decorrentes de falhas na comunicação entre os profissionais de saúde e os familiares e a falta de envolvimento da própria criança em seu cuidado.
Isso tem levado a danos desnecessários como lesões por pressão (dano causado na pele e nos tecidos moles), quedas e a administração incorreta de medicamentos. Promover a participação do paciente, na melhoria da segurança dos cuidados em saúde, implica a integração deste na tomada de decisão, de forma consciente e informada.
“Desta forma, o paciente e seus familiares, em especial quando se trata de crianças e adolescentes, devem conhecer todo o plano de diagnóstico e tratamento delineado pela equipe de saúde, participando de ações como: prover todas as informações sobre histórico de doenças prévias, alergias e outras circunstâncias, identificar mudanças não planejadas ocorridas no cuidado, questionar ativamente as propostas de tratamento e acompanhar sua execução”, alerta a pediatra Priscila Amaral, membro da SOBRASP.
O Wegovy (semaglutida 2,4 mg) foi aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa) para tratar gordura no fígado com inflamação em adultos com fibrose moderada a avançada, sem cirrose hepática. O medicamento servirá para combater a enfermidade esteatohepatite associada à disfunção metabólica.
A aprovação chega após avaliação dos resultados do estudo de fase 3 ESSENCE. O levantamento mostrou que após 72 semanas, 63% dos pacientes tratados com o produto ficam sem a inflamação, em comparação com 34,3% no grupo placebo.
Foi constatado também que 37% dos pacientes tratados registraram melhora no estágio da fibrose hepática, contra 22,4% no grupo placebo.
Outros 33% dos pacientes conseguiram reverter a inflamação e melhoraram o grau de fibrose. Oito em cada dez pessoas com excesso de peso enfrentam o problema. Já na população geral, 30% da população mundial é acometida com a doença.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou o recolhimento do suplemento infantil Flock Dent Camomilina, da Unicorp Terceirizze Brasil Industrial Ltda. – Medphar Farmacêutica Ltda. A medida chegou após uma ação de fiscalização da agência, na última quarta-feira (10).
A determinação faz com que o produto não seja mais comercializado, distribuído , fabricado, divulgado e consumido. Segundo a entidade, a indicação do produto para a primeira dentição de bebês não foi autorizada.
O produto ainda possui ingredientes não permitidos para a faixa etária indicada. Além disso, a Fórmula Pediátrica para Nutrição Enteral e Oral - Nesh Pentasure Pedia, da empresa Nunesfarma Produtos Farmacêuticos Ltda, também foi alvo da determinação. Com isso, o item teve a suspensão da sua comercialização, da distribuição e do seu consumo.
Foi identificado um erro na rotulagem dos itens. A menção "Fórmula hidrolisada", descrita no rótulo do produto, não pode fazer parte do produto e por isso precisa ser excluída.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou a suspensão e recolhimento do Tônico Capilar Minoxi Turbo Glammour Professional, da empresa Gammour Professional Ltda – Me. A medida publicada nesta segunda-feira (08), proibiu a comercialização, distribuição, fabricação e divulgação do produto.
A agência explicou que o item foi registrado como cosmético, mas seu rótulo possui indicações do medicamento Minoxidil, classificando que o tônico "estimula o crescimento capilar, estimulante do crescimento de barba, cabelo e bigode”.
O Macho Alfa Minoxidil Turbo 15% foi alvo da restrição. Segundo a entidade, o produto não possui registro e deve também ser apreendido. De acordo com a empresa, a substância não é permitida para produtos de higiene pessoal, cosméticos e perfumes.
Além disso, os cosméticos da marca Sabô Ageless e da Maquiagem Capilar da marca Bangna, também foram alvos da proibição. A Anvisa disse que os produtos, que são de empresas desconhecidas, estavam sendo fabricados e anunciados sem possuir registro como cosméticos.
Objetos da Acta BTI, vendido como larvicida biológico, de origem desconhecida, e os da empresa Gasparelo Produtos de Limpeza e Higiene Ltda, foram proibidos. A medida chega já que esses produtos não foram registrados na Agência como saneantes.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou o recolhimento do suplemento alimentar líquido Power Honey, conhecido como "melzinho estimulante", produzido pela Alemed Nutracêutica Indústria e Comércio Ltda. A decisão foi publicada na sexta-feira (29).
Além do recolhimento, a Anvisa suspendeu a comercialização, a distribuição, a fabricação, a divulgação e o consumo do produto.
Segundo o órgão, o rótulo e o material de divulgação do Power Honey apresentam indicações terapêuticas não comprovadas, o que pode levar o consumidor a erro sobre a composição do suplemento. A rotulagem também inclui alegações como “estimulante natural”, que não possuem aprovação.
A agência informou ainda que o produto contém conservantes — entre eles benzoato de sódio e sorbato de potássio — em quantidades superiores ao permitido pela regulamentação.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou, nesta quinta-feira (23), a suspensão do hormônio nesterone, dos implantes de testosterona manipulados, da empresa Elmeco Serviços Farmacêuticos e Treinamento Profissional Ltda. Com a medida, a entidade está proibida de comercializar, manipular e divulgar sobre os produtos.
De acordo com a Anvisa, a suspensão ocorreu após a comprovação da manipulação irregular e da adulteração generalizada de todos as preparações estéreis da empresa. Os problemas teriam sido causados por falhas nas boas práticas de manipulação.
O órgão disse que as falhas representam um grave risco de contaminação cruzada e microbiana. A Anvisa explicou ainda que itens do tipo devem ser manipulados sob rigorosas condições assépticas, visando garantir a segurança da sua administração.
O hormônio Nesterone e os Implantes de Testosterona manipulados pela Elmeco Serviços Farmacêuticos e Treinamento Profissional Ltda também foram suspensos. A iniciativa estabeleceu ainda a comercialização, a manipulação, a divulgação e o uso dos hormônios.
A medida foi tomada devido à irregularidade constatada na manipulação do Nesterone, hormônio indicado para inibir a menstruação e seus efeitos colaterais, como cólicas intensas, sangramentos excessivos e tensão pré-menstrual. No entanto, ele nunca teve a sua eficácia e segurança comprovadas pela Anvisa.
A Anvisa informou que os Implantes de Testosterona estão proibidos e suspensos pois foram embalados em frasco-ampola, não apresentaram nenhum estudo de validação para o processo de limpeza e de despirogenização (esterilização que inativa os pirogênios, causadores da febre) dos frascos e batoques, criando um enorme risco de contaminação por endotoxinas bacterianas.
A Agência Nacional de Vigilância Sanitária (Anvisa) concedeu, neste domingo (5), autorização para a importação excepcional de 2.600 frascos de Fomepizol, um medicamento injetável essencial para o tratamento de pessoas com intoxicação por metanol. O metanol é uma substância frequentemente associada ao consumo de bebidas alcoólicas adulteradas ou falsificadas.
A medida emergencial foi solicitada pelo Ministério da Saúde e será coordenada pela Organização Pan-Americana da Saúde (Opas). Do total autorizado, 2.500 frascos serão adquiridos pelo Ministério da Saúde, e os 100 frascos restantes serão doados pelo fabricante. O prazo de entrega do medicamento ainda será negociado
O Fomepizol, que não possui registro no Brasil, é uma das principais opções de tratamento. A importação foi autorizada rapidamente com base na RDC 203/2017, que permite a entrada de produtos sem registro em caráter de excepcionalidade para situações de vigilância sanitária.
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou o Edital de Chamamento Internacional 17/2025, para identificar fabricantes e distribuidores internacionais de um antídoto para intoxicação por metanol. O intuito é adquirir o medicamento para utilizar em casos de contaminações e hospitalizações da doença no Brasil.
Segundo o certame publicado nesta sexta-feira (3), no Diário Oficial da União (DOU), o produto em si é o Fomepizol, em ampolas de 1,5 ml e concentração de 1.000 mg/ml. O remédio é utilizado como antídoto em casos de intoxicação oral por metanol. Contaminações do tipo podem levar a situações e complicações de saúde e risco de morte.
O Fomepizol ainda não possui registro sanitário no Brasil, tornando necessário o fornecimento através de outros países para atender à demanda do Sistema Único de Saúde (SUS).
O Ministério da Saúde afirmou que há uma necessidade urgente de conseguir o abastecimento nacional do medicamento, para estabelecer a segurança assistencial em situações de emergência.
Um lote do medicamento clonazepam teve recolhimento voluntário nesta quarta-feira (1º). A informação foi comunicada pelo laboratório Teuto. A substância é o genérico do rivotril, utilizado para diferentes condições neurológicas e psiquiátricas.
A empresa informou que o lote recolhido é o 3591454 do clonazepam 2,5 mg/ml, solução oral, de 20 ml. Segundo O GLOBO, a medida ocorreu “após ser constatado comprometimento da eficácia terapêutica, resultando na ausência do efeito esperado”.
“O recolhimento será iniciado de forma preventiva por meio da comunicação direta às autoridades de Vigilância Sanitária e a toda rede de distribuição do produto, seguindo as premissas da normativa de recolhimento estabelecida pela Agência Nacional de Vigilância Sanitária (Anvisa)”, disse a entidade por meio de nota.
O laboratório explicou ainda que pacientes que utilizam as unidades do lote podem estar sem tratamento adequado. Foi indicado a interrupção do uso desses produtos para consumidores que tinham adquirido o produto.
Outras duas versões do rivotril se encontram em falta nas farmácias do país: a em gotas 2,5 mg/mL e o comprimido sublingual 0,25 mg.
Segundo a reportagem, a Blanver, farmacêutica responsável pelo registro do remédio no Brasil, apontou que a previsão é que o abastecimento do em gotas seja regularizado ainda neste ano, e o sublingual durante o primeiro semestre de 2026.
O advogado sanitarista, Thiago Lopes Cardoso Campos, foi aprovado para a diretoria da Agência Nacional de Vigilância Sanitária (Anvisa). O pleito do jurista baiano foi analisado no Plenário do Senado, nesta terça-feira (19), e teve a indicação (MSF 35/2025) aprovada com 49 votos a favor e 5 votos contrários.
Atualmente, Thiago Campos é coordenador da consultoria jurídica da Empresa Brasileira de Serviços Hospitalares (Ebserh) e conselheiro titular do Conselho Estadual de Saúde da Bahia.
Segundo informações da Agência Senado, ele ainda atuou no Ministério da Saúde como gerente de projetos da Secretaria de Atenção à Saúde e diretor de programa da Secretaria de Gestão do Trabalho e da Educação da Saúde.
A Anvisa é uma agência reguladora, vinculada ao Ministério da Saúde, responsável pelo controle sanitário de produtos, ambientes e processos. A diretoria do órgão é composta por um diretor-presidente e quatro diretores, todos indicados pelo presidente da República e nomeados por ele após aprovação pelo Senado.
Entre as análises da indicação, o advogado foi sabatinado pela Comissão de Assuntos Sociais (CAS) do Senado na última semana e destacou o papel da Anvisa na busca pela eficiência do SUS e na diminuição dos riscos de adoecimento da população.
“A Anvisa sempre toma decisões pautadas pela ciência e tem as pessoas como patrimônio principal, com seu corpo técnico de servidores extremamente qualificados, mas que precisam também se sentir parte desse processo e voltar a sentir o significado das ações e o valor que a sociedade lhes atribuiu”, afirmou o gestor na sabatina. As informações são da Agência Senado.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do medicamento Voranigo® (vorasidenibe). O medicamento, inibidor de enzimas, é disponibilizado no formato de comprimidos, de uso diário, produzidos pela farmacêutica Servier e utilizados no tratamento de câncer cerebral.
Segundo a Agência Brasil, a entidade explicou que o medicamento é indicado para pacientes a partir dos 12 anos com tipos específicos de gliomas difusos chamados astrocitomas ou oligodendrogliomas, de baixo grau (grau 2), com mutações na enzima IDH 1 ou 2, que já foram submetidos a procedimento cirúrgico e que não tenham indicação de radioterapia ou quimioterapia imediata.
A empresa explicou que o produto atua bloqueando as enzimas IDH1 e IDH2 mutadas, responsáveis pela produção de substâncias que estimulam o crescimento de células tumorais.
Segundo o oncologista Fernando Maluf a medida é considerada como o maior avanço na área de gliomas dos últimos 20 anos.
“Gliomas são os tumores cerebrais mais comuns que existem. Os de baixo grau acometem preferencialmente uma população muito jovem, que começa a desenvolver esse tumor desde a infância e adolescência até adulto jovem”, disse em entrevista à Agência Brasil.
A injeção para perda de peso denominada de Godzilla em conjunto com canetas emagrecedoras com manipulação irregular estão no rol de produtos que podem ser recolhidos ou interditados no Brasil e em Salvador, em caso de ausência de normas sanitárias vigentes.
Apesar da demonstração de resultados mais eficazes do que Ozempic e Mounjaro, a substância retatrutida, utilizada na Godzilla não possui nenhum registro no país, como explicou à Agência Nacional de Vigilância Sanitária (Anvisa) ao Bahia Notícias. Segundo a entidade, não há nenhum medicamento à base dessa substância registrado no Brasil. A Anvisa disse ao BN, por meio de nota, que mesmo existindo estudo clínico autorizado para a substância, nenhum medicamento deste tipo possui comercialização autorizada no Brasil até o momento.
De acordo com o órgão, a importação e comercialização de medicamentos eventualmente produzidos em outros países e que não possuam registro sanitário no Brasil configura crime de contrabando. A prática pode ser julgada e tratada em instâncias policiais.
A Vigilância Sanitária de Salvador, ligada à Secretaria Municipal de Saúde, comunicou acerca de canetas manipuladas irregulares, que, quando identificadas, medidas imediatas serão adotadas. Entre elas, estão os recolhimento dos produtos, interdição de lotes ou áreas de manipulação, inutilização de insumos, lavratura de autos de infração.
Conforme o órgão, em casos mais graves, pode ocorrer ainda a suspensão temporária das atividades do estabelecimento até a regularização. No entanto, mesmo com as possíveis restrições, alguns estabelecimentos produzem os medicamentos manipulados sem autorização.
Em entrevista ao BN, o presidente do Conselho Regional de Medicina do Estado da Bahia (Cremeb), Otávio Marambaia, comentou sobre os médicos que pressionam pacientes a utilizarem esses produtos.
“Qualquer paciente que se sentiu de alguma forma assediado por um médico para comprar qualquer medicamento no seu consultório deve realizar uma denúncia ao conselho. Essas canetas não podem ser usadas do jeito que estão sendo utilizadas, porque é um medicamento com efeito colateral. Embora sejam seguras quando usadas com orientação médica, elas podem causar problemas”, disse Marambaia.
O representante do Cremeb alertou ainda a respeito da proibição da aplicação desses medicamentos em consultórios como forma de lucro.
“O médico não está autorizado a fazer qualquer coisa sem o consentimento do paciente. De fato, às vezes você tem que ensinar o paciente, por exemplo, a forma de usar, isso pode ser feito na primeira aplicação em consultório, mas o médico não pode, de maneira nenhuma, fazer da aplicação uma forma, inclusive, de ganhar dinheiro ou de fazer com que o paciente obtenha um produto no seu próprio consultório”, complementou.
A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a comercialização dos medicamentos Colágeno + Vitamina C; L-Treonato de Magnésio; Espinheira Santa e também o Xarope da Vovó Isabel ou apenas Xarope da Vovó.
Segundo a Agência Brasil, foi determinada a proibição da venda do ingrediente alimentar Curcumyn Long e do lote L42158 do insumo farmacêutico “Dysport® (Toxina Botulínica A), 150 U”.
De acordo com a reportagem, a entidade afirmou que os medicamentos Xarope da Vovó Isabel e Xarope da Vovó são fabricados “por empresa desconhecida”. A comprovação da propaganda e comercialização do produto não têm registro, notificação ou cadastro na Anvisa.
A empresa do Colágeno + Vitamina C, L-Treonato de Magnésio e da Espinheira Santa - Grupo Nutra Nutri Ltda - “não possui autorização de funcionamento” da Anvisa. O lote L42158 do Dysport®, da fabricante Beaufour Ipsen Farmacêutica Ltda “não reconhece o lote como original, se tratando, portanto, de falsificação.”
Já o suplemento alimentar Curcumyn Long “não atende às especificações referenciadas na legislação quanto à forma de obtenção”.
A Agência Nacional de Vigilância Sanitária (Anvisa) estabeleceu a proibição de quatro cosméticos da empresa Be Factory Laboratories, Indústria, Comércio, Importação e Exportação Ltda, e determinou o recolhimento de produtos da marca, por referência a Cannabis. A medida foi publicada no Diário Oficial da União (DOU), desta terça-feira (22).
Segundo a Anvisa, a ação foi motivada porque a expressão “Hemp”, presente no rótulo dos produtos, estaria sugerindo que os produtos contêm substância derivada de Cannabis em sua composição, confundindo os consumidores.
A decisão atinge todos os lotes dos produtos Califórnia Drop Sérum Facial Hemp Vegan, PsiloGlow Lip Balm Hemp Vegan, Magic LSD Máscara Capilar Hemp Vegan e Alucina Creme Hidratante Facial Hemp Vegan.
Foi decidido também a proibição da comercialização, distribuição, fabricação, propaganda e uso desses produtos. A entidade frisou ainda que no Brasil, o uso de derivados de Cannabis está autorizado exclusivamente para medicamentos e produtos de Cannabis autorizados pela Anvisa.
Nessas situações, esses produtos seguem o regime de controle especial, referenciados na Legislação.
Uma clínica de estética em Vitória da Conquista foi interditada definitivamente nesta quinta-feira (10) após determinação do Ministério Público do Estado da Bahia (MP-BA). A ação, conduzida pela Vigilância Sanitária e pelo Programa de Proteção e Orientação ao Consumidor (PROCON), revelou que pelo menos duas mulheres sofreram ferimentos estéticos.
As fiscalizações iniciais já haviam identificado problemas como produtos vencidos, outros sem autorização da Agência Nacional de Vigilância Sanitária (Anvisa) e o funcionamento do estabelecimento sem o alvará sanitário.
Segundo informações do Blog do Anderson, parceiro local do Bahia Notícias, a clínica já havia recebido um prazo de 90 dias para regularização, mas não cumpriu as exigências, o que resultou na interdição definitiva.
Ao mesmo tempo, agentes da Polícia Civil concluiu um inquérito que expôs situações alarmantes no mesmo local. A investigação revelou que duas mulheres sofreram lesões sérias após procedimentos estéticos realizados na clínica, sendo que uma delas ficou com deformidade permanente.
 Imagens dos agentes fazendo fiscalização no local | Foto: Reprodução / Prefeitura de Vitória da Conquista
Imagens dos agentes fazendo fiscalização no local | Foto: Reprodução / Prefeitura de Vitória da Conquista
O inquérito apontou práticas perigosas e anti-higiênicas, incluindo a utilização de seringas com plasma aquecidas em micro-ondas domésticos, que teriam causado explosões. Também foram encontrados medicamentos de uso restrito a prescrição médica, falta de higiene no ambiente e durante os atendimentos, e uso de telefone celular pelos profissionais durante os procedimentos.
Em decorrência das descobertas, dois profissionais ligados ao estabelecimento — um fisioterapeuta e uma farmacêutica — foram indiciados. Eles responderão por crimes como exercício ilegal da medicina e falsificação de produtos terapêuticos, aguardando o processo em liberdade.
O espaço permanecerá interditado até que todas as irregularidades sejam corrigidas, com as autoridades mantendo o acompanhamento do caso. Em nota, o advogado do fisioterapeuta indiciado afirmou que a interdição foi "equivocada e desproporcional".
Segundo a defesa, apenas três das dez salas da clínica foram interditadas para ajustes, e toda a documentação exigida pela Vigilância Sanitária teria sido enviada em abril, sem retorno. A defesa informou ainda que medidas legais foram tomadas e que a reabertura da clínica é esperada nas próximas horas.
A Agência Nacional de Vigilância Sanitária (Anvisa) suspendeu a venda e determinou o recolhimento de todos os lotes dos produtos da marca de gelados comestíveis da marca AICE. Os sabores proibidos foram o Milk Melon, Juju Apple, Frutyroll, Nanas e Berry Chocomax.
Com a medida, a empresa não pode realizar a distribuição, importação, propaganda e utilizar os produtos. A ação ocorreu após a agência identificar a ausência da declaração do corante tartrazina por extenso na rotulagem dos gelados comestíveis dos sabores MILK MELON, JUJU APPLE, FRUTYROLL e NANAS.
Segundo o órgão, não havia a declaração da presença de amendoim na lista de ingredientes ou a declaração de alergênico na rotulagem do sabor BERRY CHOCOMAX.
A punição ocorreu já que a declaração sobre a presença de ingredientes alergênicos é obrigatória no Brasil e visa prevenir consumidores que possam ter restrições a esses itens. A propaganda dos produtos da empresa COMÉRCIO LUX LIFE & CIA. LTDA. (LUX LIFE) também foi suspensa no país. Conforme a Anvisa, a entidade promovia, por meio do seu site, indicações terapêuticas e alegações de saúde não aprovadas e enganosas em propagandas de alimentos.
Entre as promessas enganosas estavam a redução do colesterol ruim, prevenção do câncer de próstata, ajuda no tratamento de diabetes, redução da glicemia, tratamento cardiovascular, tratamento de próstata, ansiedade, estresse, entre outros.
Em nota enviada ao Bahia Notícias, a AICE explicou que "todos os produtos citados mantêm a fórmula original, não oferecem risco a saúde e possuem licenças sanitárias vigentes, emitidas por autoridades competentes. A ação descrita pela Anvisa configura-se como uma medida preventiva de rotulagem, sem qualquer relação com a composição, qualidade ou segurança dos produtos"
"AICE informa que os ajustes solicitados se referem exclusivamente à forma de apresentação de determinados ingredientes no rótulo, como a substituição de códigos técnicos por nomes escritos por extenso, conforme previsto em norma específica. A atualização dos rótulos já está em andamento, de forma imediata e coordenada, seguindo o padrão internacional de conformidade da marca, presente em 26 países e mais de 700 mil", disse a empresa na nota.
Atualizada às 14h44 do dia 15 de julho com o posiconamento da AICE.
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou, nesta segunda-feira (7), um informe de segurança sobre os riscos relacionados ao uso de alisantes capilares que contêm substâncias como o formol. Segundo o órgão, os produtos irregulares podem causar desde irritações na pele até problemas respiratórios e danos irreversíveis à estrutura capilar. As informações são da Agência Brasil.
Atualmente, o formol é permitido em produtos cosméticos no Brasil apenas como conservante, em concentrações de até 0,2%, e como endurecedor de unhas, até 5%. Seu uso como agente alisante é proibido e representa sérios riscos à saúde.
A Anvisa chama a atenção que “o ácido glioxílico, também proibido para essa finalidade, pode causar severos danos quando aquecido, sendo especialmente perigoso quando combinado com outros procedimentos, como a descoloração dos fios capilares”.
O informe traz orientações detalhadas para consumidores e profissionais de salões de beleza:
- consumidores devem verificar se o produto é regularizado junto à Anvisa;
- evitar produtos sem rótulo ou com promessas enganosas;
- seguir corretamente as instruções de uso;
- ficar atento a sinais como coceira, ardência ou dificuldades respiratórias.
Os profissionais devem utilizar apenas produtos regularizados e recusar o uso de substâncias proibidas, mesmo que a pedido do cliente. A Anvisa alerta ainda que os profissionais adotem medidas de proteção individual e mantenham os ambientes ventilados.
A Anvisa esclarece também que “a adição de formol a cosméticos é considerada infração sanitária grave e pode configurar crime hediondo, conforme o artigo 273 do Código Penal”. As informações são da Agência Brasil.
A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a fabricação, comercialização, propaganda e uso dos extratos de cogumelo da linha Mushdrops, produzidos pela empresa Mush Mush Club. A decisão foi publicada no Diário Oficial da União nesta terça-feira (01). A determinação atinge os produtos identificados como Juba de Leão, Reishi, Cordyceps, Chaga e Turkey Tail, todos vendidos em formato de gotas. Além da proibição, a agência também determinou a apreensão dos itens.
Segundo a Anvisa, os produtos estavam sendo vendidos como se fossem medicamentos, embora não tenham registro ou regularização sanitária. “Assim, não é possível garantir a segurança de uso desses produtos, nem saber a sua procedência e o controle de riscos durante a sua produção”, informou a agência.
A Anvisa ressaltou ainda que a empresa não possui Autorização de Funcionamento (AFE) para fabricar medicamentos, o que impede a legalidade da comercialização dos extratos.
No mercado, os cogumelos da linha Mushdrops são divulgados como "superalimentos" que supostamente auxiliam no bem-estar físico e mental. Entre os efeitos prometidos estão controle da ansiedade, melhora da imunidade, aumento de energia, qualidade do sono e função respiratória. Em publicações nas redes sociais, a empresa afirma que os cogumelos não provocam alterações de percepção e não causam “onda”.
“Esses cogumelos não causam alterações na percepção, mas ajudam o corpo a funcionar melhor”, diz a empresa em um post no Instagram.
As informações foram apuradas pela Folha de S.Paulo que tentou contato com a Mush Mush Club por meio do WhatsApp, e foi informada de que o setor jurídico responderia. O site da empresa estava fora do ar nesta quarta-feira (02), mas o perfil no Instagram permanecia ativo.
A Anvisa também alertou que a medida vale para qualquer pessoa física ou jurídica — incluindo veículos de comunicação — que comercialize ou divulgue os produtos em questão.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o medicamento Mounjaro para o tratamento da obesidade no Brasil. A medida foi publicada no Diário Oficial da União (DOU), desta segunda-feira (9).
Já a Ozempic (semaglutida), que está sendo vendida desde maio, mas era permitida somente para tratar a diabete tipo 2, também passou a ser utilizada no tratamento da obesidade.
Com isso, a autorização da Anvisa possibilita que o produto seja indicado para obesidade desde que a doença esteja relacionada a pelo menos uma comorbidade. A aplicação do medicamento acontece de forma injetável e semanal. As marcas estarão disponíveis nas dosagens 2,5 mg e 5 mg.
Na última semana, os valores das canetas injetáveis Ozempic e Wegovy foram reduzidos no Brasil. A farmacêutica Novo Nordisk, responsável pelos produtos, informou, por meio de comunicado, que a medida tem o intuito de tornar os tratamentos de diabetes e obesidade mais acessíveis e para diminuir também o aumento de falsificação e manipulação das marcas.
O reajuste foi feito nas principais plataformas de e-commerce das grandes redes de farmacêuticas brasileiras e também no varejo físico.
“Esse ajuste na nossa política de preços é um passo fundamental para garantir que mais pessoas tenham acesso aos tratamentos necessários para o controle de doenças crônicas. Com o abastecimento diz a fabricante”, afirmou a general manager da entidade, Isabella Wanderley.
A goma à base de tadalafila proibida pela Agência Nacional de Vigilância Sanitária (Anvisa), a 'Metbala', foi lançada em março deste ano pelo influenciador Jon Vlogs, dono de um perfil nas redes sociais com mais de 10 milhões de seguidores.
A decisão, publicada no Diário Oficial da União na última quarta-feira (14), suspendeu o produto por ser produzido por uma empresa que não possui autorização para fabricar medicamentos e suspendeu a distribuição, fabricação, manipulação, propaganda e uso de todos os lotes do medicamento.
A empresa em questão é a FB Manipulação Ltda., sediada em Mogi Guaçu (SP).
"As ações de fiscalização determinadas também se aplicam a quaisquer pessoas físicas/jurídicas ou veículos de comunicação que comercializem ou divulguem esse produto", diz o texto.
Na época que divulgou o produto para auxílio na disfunção erétil, Jon Vlogs garantiu que o produto era legalizado.
“O uso de medicamentos deve ser feito com prescrição e acompanhamento médico. A automedicação coloca sua vida em risco. Esses produtos não são inofensivos”, alertou a Anvisa em comunicado oficial.
O anúncio divulgado pelo blogueiro viralizou nas redes sociais e chamou atenção pelo teor. No vídeo, Jon aparecia rodeado de mulheres desacordadas em um cenário de festa e, após tomar a "balinha", sugere que o produto resolveria "problemas íntimos". Antes de ser apagado da plataforma do influenciador, o vídeo recebeu 46 mil curtidas.
Em entrevistas, Jon Vlogs falou sobre o produto. Ao podcast Flow, o influenciador contou que já foi viciado na substância em 2019, mas parou de usar, e pensou em criar a gominha porque percebeu que os jovens eram viciados, mas tinham vergonha de andar com o remédio.
"Criei um gummy de tadalafia, vem em uma capsula. Porque o jovem está tomando tadala para não passar vergonha. E o jovem tá viciando no tadala pelo sentido de, se não toma o tadala você entra em jogo já mal. As vezes pode não ter nada, mas só de já ter o tadala você entra na performance que nem um rei. [...] Vou pegar o cara que tem vergonha de estar com o remédio de drogaria, e vai tá lá com um negócio bonito. 'Ah, tá comendo o que? Bala fini."
A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a comercialização da pastilha, tipo gummy, de tadalafila “Metbala”, da empresa FB Manipulação Ltda. nesta quarta-feira (14). O produto foi lançado no início do ano pelo influenciador digital "Jon Vlogs", que acumula mais de 20 milhões de seguidores em suas redes sociais.
A decisão também veta a fabricação, a manipulação, a propaganda e o uso de todos os lotes do produto. Segundo a Anvisa, a Metbala nunca recebeu autorização para ser distribuída no Brasil. Quando lançou o gummy, John Vlogs chegou a afirmar que o produto era "100% legalizado e aprovado pela Anvisa" em postagem no X.

Foto: Reprodução / X
"A medida foi adotada porque o produto não tem qualquer tipo de regularização na Agência. Além disso, a empresa identificada não tem autorização da Anvisa para fabricar medicamentos", afirma a autarquia.
A Anvisa explicou que a proibição também se aplica a qualquer pessoa, física ou jurídica, ou veículos de comunicação, que comercializem ou divulguem o produto. Quem descumprir a ordem, por se tratar de uma infração sanitária, está sujeito a penalidades, incluindo multas.
"De acordo com a legislação, medicamentos só podem ser comercializados por farmácias e drogarias e precisam estar registrados na Agência. O registro é a comprovação de que o produto possui eficácia, segurança e qualidade", continua.
A agência ainda alertou que a tadalafila, fármaco indicado para tratamento da disfunção erétil, é um medicamento "sujeito à prescrição médica e seu uso depende de uma avaliação sobre as condições específicas do paciente". Em casos raros, por exemplo, a tadalafila pode provocar reações como falta de ar e problemas cardíacos, como infarto e acidente vascular cerebral (AVC).
A reportagem do “O Globo” entrou em contato com o influenciador, mas não obteve resposta.
A Agência Nacional de Vigilância Sanitária (Anvisa) retomou a interdição cautelar da Colgate Total Clean Mint, na última quarta-feira (30). A medida voltou a entrar em vigor, após ser determinada no dia 27 de março. No entanto, o ato foi suspenso por conta de um recurso apresentado pela Colgate.
Porém, a própria entidade retirou o recurso que tinha efeito suspensivo contra a interdição. Com isso, a interdição do produto volta a ficar em vigor.
A medida contra a Colgate aconteceu depois que foram registradas ocorrências envolvendo 13 tipos de reações adversas em decorrência do consumo do produto. Os sintomas elencados nos registros foram: inchaço nas amígdalas, lábios e mucosa oral.
A sensação de ardência, dormência nos lábios e na boca, boca seca, gengiva irritada e vermelhidão, também foram descritos por alguns consumidores. A Clean Mint, pasta interditada, é uma nova versão de um dos cremes dentais mais populares da marca, a Colgate Total 12.
O primeiro medicamento indicado para tratamento para a doença de Alzheimer sintomática inicial, foi aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa) na última terça-feira (22). A Doença de Alzheimer (DA) é uma condição neurodegenerativa progressiva e fatal, reconhecida pela deterioração da memória, função cognitiva e atividades motoras. Estes são os sintomas que o Kisunla [donanemabe], medicamento fabricado pela farmacêutica Eli Lilly, é indicado para tratar, ainda que em fase inicial.
Conforme dados do Ministério da Saúde, em 2023, cerca de 1,2 milhão de pessoas eram portadoras da Doença de Alzheimer no Brasil e a cada ano, uma médica de 100 mil novos casos eram diagnosticados, até então. O Bahia Notícias conversou com a especialista em Neurologia Roberta Kauark para compreender a dinâmica da doença e como o novo medicamento do alterar os tratamentos já existentes.
Segundo estudos oficiais, “a doença instala-se quando o processamento de certas proteínas do sistema nervoso central começa a dar errado". "Surgem, então, fragmentos de proteínas mal cortadas, tóxicas, dentro dos neurônios e nos espaços que existem entre eles. Como consequência dessa toxicidade, ocorre perda progressiva de neurônios em certas regiões do cérebro, como o hipocampo, que controla a memória, e o córtex cerebral, essencial para a linguagem e o raciocínio, memória, reconhecimento de estímulos sensoriais e pensamento abstrato”, diz a nota disponível na cartilha do Ministério.
É neste cenário que o Kisunla [donanemabe] atua: o medicamento é um anticorpo monoclonal que se liga à proteína em questão, a beta-amiloide. O medicamento atua se ligando a esses aglomerados da proteína e reduzindo-os, prometendo retardar a progressão da doença.
Com relação ao panorama da doença no país, a neurologista cita que estudos atuais chegam a contabilizar um crescimento de 22% nos diagnósticos. Ela afirma, no entanto, que isso se justifica por uma conjunção de fatores, incluindo o aumento da cobertura de saúde pública, por meio do SUS. Os dados que assustam, no entanto, são os de óbitos em decorrência da doença.
Uma pesquisa realizada por pesquisadores da Universidade Federal de São Paulo (Unifesp) e do Centro Médico da Universidade Columbia, nos Estados Unidos, aponta que o Brasil registrou mais de 211 mil mortes por complicações associadas à doença entre os anos 2000 e 2019. Foram analisados os dados registrados no Sistema de Informação sobre Mortalidade do Departamento de Informática do Sistema Único de Saúde (Datasus).
“Se a gente diagnostica mais, a doença é uma doença incurável que progride e pode levar ao óbito com suas complicações, é compreensível que mais pacientes estejam, então, falecendo por complicações da doença. E acho que, além disso, como eu falei, tem também o fato de hoje em dia termos maior preenchimento de dados, dados mais seguros e maior acesso da população que está envelhecendo a rede de saúde”, explica a médica.
Nos centros de referência do Sistema Único de Saúde (SUS), o tratamento para a DA é multidisciplinar e integral. Os medicamentos utilizados ajudam a retardar a evolução dos sintomas.
Para a aprovação do Kisunla, o relatório analisado pela Anvisa conta com um estudo realizado pela farmacêutica em oito países, com 1.736 pacientes em estágio inicial. O estudo mostra que com a posologia de 700 miligramas do medicamento a cada quatro semanas nas três primeiras doses e, depois, com 1.400 miligramas a cada quatro semanas, os pacientes tratados com donanemabe apresentaram menor progressão e maior estabilidade na doença de Alzheimer (DA), em comparação aos pacientes tratados com placebo.
“Baseado nos estudos que foram realizados, a medicação mostrou melhora tanto em exames, que mostraram menor carga de beta-milóide cerebral, como também melhora clínica desses pacientes. Isso vai trazer um, vai espelhar uma melhora na qualidade de vida e de autonomia desses pacientes”, afirma.
No entanto, o medicamento possui contra indicações: O tratamento é contraindicado em pacientes que estejam tomando anticoagulantes, ou que tenham sido diagnosticados com angiopatia amiloide cerebral (AAC) em ressonância magnética. Nestes casos, os riscos são considerados maiores que os benefícios, aponta a Anvisa.
A especialista, Kauark, chama a atenção para a questão. “[O medicamento] É um avanço, mas a gente precisa chamar atenção para algumas coisas. Primeiro, é que a medicação mostrou benefícios numa população com declínio cognitivo leve, ou seja, anterior à demência e em demência leve nos pacientes. A segunda coisa é que mesmo nessa população bem específica, houve uma complicação maior de sangramento intracerebral em uma parte desses pacientes. Então, mesmo nos pacientes com demência inicial ou declínio cognitivo leve, existe outra população com um maior risco do uso. A mensagem que fica é que esses pacientes precisam ser muito bem selecionados”, destaca.
Ao falar sobre o perfil dos pacientes para a medicação, a médica detalha que já existe uma mudança nos pacientes diagnosticados. Considerando que a DA está diretamente ligada a questões do envelhecimento, a doença ainda é mais comum entre pessoas com mais de 60 anos, no entanto, o aparecimento precoce da doença se torna mais comum. “É possível o aparecimento antes dos 65 anos de idade, de forma muito precoce. O Alzheimer precoce, entre os 30 a 50 anos, a nossa suposição é que pela genética associada, esse tipo de diagnóstico aumenta. Então, nesses pacientes abaixo dos 50 anos de idade, é importante a gente fazer uma investigação de causa genética para essa doença de Alzheimer”, ressalta.
Conforme a aprovação da Anvisa, o Kisunla [donanemabe] já pode ser distribuído e utilizado em território nacional, dentro das indicações e limites aprovados pela agência. Agora, a medicação aguarda precificação na Câmara de Regulação do Mercado de Medicamentos (CMED).
Para Roberta, essa etapa é fundamental para compreender como esse tratamento pode impactar no mercado. “Essa medicação passa por uma 2° etapa, que é a precificação. A gente aguarda isso com ansiedade, porque os preços praticados fora do Brasil são muito altos para o uso da medicação. Então, a gente tem que saber qual a viabilidade do uso da medicação de forma geral no Brasil. Além disso, é necessária a definição brasileira de protocolos muito bem estruturados, principalmente se a gente vislumbra o uso dessa medicação no futuro ao nível de SUS”, reflete.
A neurologista conta que “fora do Brasil, nos estudos que foram realizados, foram coletados biomarcadores e feitos exames como, por exemplo, o PET Amiloide, que a gente não tem disponibilidade facilmente no Brasil de realizar. Então, são alguns desafios que precisam ser resolvidos para que a medicação, então, possa ser usada aqui no Brasil”, conclui.
Em nota pública, a Anvisa garantiu que “como acontece com qualquer medicamento, irá monitorar a segurança e a efetividade do donanemabe sob rigorosa análise". "Serão implementadas atividades de minimização de risco para o donanemabe em conformidade com Plano de Minimização de Riscos aprovado”, escreveu a entidade.
Cerca de 41 marcas de suplementos alimentares de creatina disponíveis no mercado brasileiro foram testadas, analisadas e tiveram os resultados publicados na última quarta-feira (23) pela Agência Nacional de Vigilância Sanitária (Anvisa). Os produtos foram avaliados na concentração, na presença de matérias estranhas e na adequação da rotulagem.
Entre os itens apresentados, somente uma empresa apresentou teor do nutriente abaixo do previsto, que não teve o nome divulgado. Segundo a Anvisa, é necessário que as marcas tenham ao menos 3.000 mg de creatina e atingir até 20% de variação em relação ao valor informado na rotulagem.
Porém, o principal erro dos produtos analisados estavam nas rotulagens, a exemplo de alegações não permitidas, informações nutricionais incompletas, ausência da quantidade porções por embalagem e dados fora do padrão exigido, além de informações em línguas estrangeiras. Alguns dados também estavam fora do padrão exigido.
CONFIRA LISTA DOS SUPLEMENTOS AVALIADOS
Darklab | Pure Creatine
Iridium Labs | Creatina Fuel
Max Titanium | Creatine
Probiótica | Creatina Monohidratada
Probiótica | Creatina Caps Monohidratada
Canibal | Creatiny Monohydrate
Max Titanium | Creatine Monohidratada (caps)
Body Nutry Suplementos | Creatine 100% Pura – Micronizada – Monohidratada
Body Nutry Suplementos | Creatine 100% Pura – Micronizada – Monohidratada
Pro Healthy | Creatine Micronized – 100% Pure Ultra-Concentrated Powder
Atlhetica Nutrition | Creatine Monohydrate – 100% Pure
Iridium Labs | Atlas Creatina
Synthe Size | Creatine Powder Monohydrate
Body Shape Nutrition | Creatine Energy Monohidratada e Micronizada
Black Skull | Creatine Hardcore Pure Monohydrate
Creapure | Creafort 100% Pura
MF Musclefull | Muscle Full 100% Pura
Bulk | Creatina Monohidratada 100% Pura
FTW | Creatina Ultra
Bodyaction | Creatine Dual Power
Bodyaction | Creatine Double Force
Darkness | Creatine Muscle Energy
Integralmédica | Creatina Hardcore
Integralmédica | Creatina Hardcore (caps)
Nutrify | Creatine Monohidratada
Eat Clean Pro | Creatina Monohidratada Vegano
Universal | Creatine Monohydrate
Soldiers Nutrition | Creatine Monohydrate
Essential Nutrition | Crealift
Muscletech | Creatine
Natusvita | Creatine Micronizada
Creapure | Creatina Monohidratada
Nutrata | Creatin Up Monohidratada
Elementopuro | Suplemento Alimentar de Creatina em Pó – Creadop
True Source | Creatine 100% Pure
Shark Pro | Creatina Monohidratada 3g
Optimum Nutrition | Creatine Powder
New Millen | Creatina Monohidratada
Vitamax | Creatina Booster
3VS | Creatine Power Pó
3VS | Pure Creatine
Anvisa aprovou, nesta segunda-feira (14), o registro da vacina IXCHIQ (vacina Chikungunya recombinante atenuada), do Instituto Butantan. A vacina, de dose única, será indicada para a prevenção da doença em pessoas com 18 anos ou mais, que estejam em risco aumentado de exposição ao vírus Chikungunya. O imunizante demonstrou induzir produção robusta de anticorpos neutralizantes contra o vírus Chikungunya em estudos clínicos realizados em adultos e adolescentes que receberam uma dose da vacina.
A vacina é contraindicada para mulheres grávidas, pessoas imunodeficientes ou imunossuprimidas. Para a publicação do registro, a Anvisa definiu, em conjunto com o Instituto Butantan, um Termo de Compromisso que prevê a realização de estudos de efetividade e segurança da vacina, e de atividades de farmacovigilância ativa para ampliar o conhecimento sobre o perfil de eficácia e segurança da vacina.
O imunizante é uma vacina recombinante atenuada, desenvolvida pela farmacêutica austríaca Valneva. A fabricação será feita na Alemanha, pela empresa IDT Biologika GmbH. O Butantan prevê a fabricação no Brasil no futuro.
A vacina já havia sido aprovada por outras autoridades internacionais, como FDA, dos Estados Unidos e pela Agência Europeia de Medicamentos (EMA), para a prevenção de Chikungunya.
A Chikungunya é uma arbovirose transmitida pela picada de fêmeas infectadas do mosquito Aedes aegypti, o mesmo que transmite a dengue. O vírus chikungunya foi introduzido no continente americano em 2013 e ocasionou uma importante epidemia em diversos países da América Central e ilhas do Caribe. No segundo semestre de 2014, o Brasil confirmou, por métodos laboratoriais, a presença da doença nos estados do Amapá e Bahia. Atualmente, todos os Estados registram transmissão desse arbovírus.
AVALIAÇÃO
Para esta análise, a equipe da Anvisa avaliou a documentação submetida no dossiê de registo, que incluiu dados de produção e qualidade, e de estudos clínicos para demonstração de eficácia e segurança da vacina. Os estudos clínicos para avaliação da eficácia e segurança da vacina incluíram a avaliação de adultos nos EUA e de adolescentes no Brasil. Nestes estudos foi demonstrado que a vacina, administrada em dose única, induziu resposta robusta de anticorpos neutralizantes contra o vírus Chikungunya e que o perfil de segurança foi aceitável para a indicação aprovada.
Além disto, a Anvisa participou como convidada da avaliação da vacina IXCHIQ pela Agência Europeia de Medicamentos (EMA), no âmbito do projeto OPEN (Opening our Procedures at EMA to Non-EU authorities). Esse projeto permite que diferentes agências avaliem simultaneamente vacinas e medicamentos de interesse em saúde pública, trocando informações técnicas e científicas, mas mantendo a autonomia de cada autoridade reguladora.
A Anvisa também contou com a avaliação independente do Grupo de Trabalho para discussão do desenvolvimento não clínico e clínico de vacinas destinadas à proteção contra Arboviroses, instituído no âmbito da Câmara Técnica de Medicamentos (Cateme), composta por especialistas em arboviroses e desenvolvimento de vacinas. As informações são da Agência GOV.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou a proibição de suplementos alimentares que possuem ora-pro-nóbis no Brasil. A norma publicada no Diário Oficial da União (DOU) desta quinta-feira (03), não permite que este produto seja fabricado, vendido, distribuído e nem propagado.
O recolhimento desses produtos à base da planta já comercializados também foi estabelecido pela entidade. A agência reforçou algumas normas aos consumidores ao adquirirem os suplementos alimentares.
Entre as indicações estão o não consumo de produtos sem aprovação da Anvisa ou fora das normas sanitárias e a verificação de registros que estejam conforme a legislação vigente.
A ora-pro-nóbis (Pereskia aculeata) é definida como uma planta trepadeira cactácea e perene originária do continente americano. A planta rústica é classificada como alimentícia não convencional e utilziada de forma constante na gastronomia. Normalmente essas folhas são utilizadas em algumas receitas de pratos e até de bebidas. Já os suplementos do tipo são considerados natural e rico em proteínas e fibras.
A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu as lâmpadas fluorescentes de alta potência utilizadas em câmaras de bronzeamento artificial no Brasil. A iniciativa foi publicada no Diário Oficial da União (DOU) desta quarta-feira (2).
Foi determinada a proibição da venda, distribuição, armazenamento, fabricação, a importação, a propaganda e o uso do produto no Brasil.
A Anvisa reforçou no comunicado que as câmaras de bronzeamento artificial, de modo geral, são proibidas em território brasileiro desde novembro de 2009. Porém, a entidade explicou que elas "vêm sistematicamente sendo utilizadas de forma irregular". O novo ato, direcionado às lâmpadas, seria para reforçar a fabricação e a manutenção desses itens.
A autarquia ainda comentou dos riscos e problemas de saúde que podem ocorrer por conta das câmaras de bronzeamento artificial. Entre as questões estão as queimadura, ferimentos cutâneos, cicatrizes, câncer de pele, envelhecimento da pele; rugas; perda de elasticidade cutânea; lesões oculares como fotoqueratite; inflamação da córnea e da íris; fotoconjuntivite; catarata precoce, pterigium (excrescência opaca, branca ou leitosa, fixada na córnea) e carcinoma epidérmico da conjuntiva.
A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou a suspensão da medida que interditava a venda do creme dental Colgate Total Clean Mint. A iniciativa tinha sido divulgada anteriormente, na última quinta-feira (27), após relatos de reações relacionados ao uso do produto. O cancelamento da norma chega após a entidade apresentar recurso.
No entanto, a agência reforçou a orientação, para que os consumidores e profissionais de saúde notifiquem casos de reações adversas, se alguma situação do tipo ocorrer.
Após retirar a interdição, a agência liberou a venda e comercialização do creme dental. A Anvisa explicou que vai continuar com a fiscalização seguindo os trâmites administrativos da agência.
A Agência Nacional de Vigilância Sanitária (Anvisa), por meio da Diretoria Colegiada, aprovou, nesta quarta-feira (26), a Consulta Pública (CP) para revisar a atual regulamentação de produtos de cannabis. Entre as questões que serão analisadas, estão temas como atendimento às Boas Práticas de Fabricação, vias de administração, publicidade de produtos, validade da autorização sanitária, prescrição, dispensação, importação de insumos para produção nacional, rotulagem, entre outros.
A consulta ainda tem o objetivo de atualizar e mudar as regras de venda e prescrição de produtos feitos à base do produto. O órgão indica que os produtos sejam comercializados em farmácias de manipulação.
Segundo O GLOBO, atualmente, a comercialização é feita somente em farmácias sem manipulação ou drogarias, sendo liberado nesses estabelecimentos, com a receita médica de controle especial.
O comunicado da Anvisa apontou que a minuta de resolução ficará aberta por 60 dias e, durante este período, qualquer interessado poderá fazer contribuições à proposta de atualização da regulamentação efetuada pela agência.
De acordo com a autarquia, além do registro como medicamento, a regularização deste tipo de item seria o único caminho regulatório possível para a comprovação da qualidade mínima necessária aos produtos de cannabis.
Os diretores aprovaram também a abertura de um processo regulatório para revisar a resolução RDC 660/2022, sobre a importação excepcional de produtos de cannabis para uso pessoal.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou a suspensão da venda da pasta de dente Colgate Clean Mint após relatos de efeitos adversos em alguns consumidores. A medida foi anunciada no Diário Oficial desta quinta-feira (27).
A autarquia informou que oito notificações, envolvendo 13 tipos de reações adversas, foram registradas após o consumo do produto. Os sintomas elencados nos registros foram: inchaço nas amígdalas, lábios e mucosa oral.
A sensação de ardência, dormência nos lábios e na boca, boca seca, gengiva irritada e vermelhidão, também foram descritos por alguns consumidores. Segundo o G1, a Clean Mint, pasta interditada, é uma nova versão de um dos cremes dentais mais populares da marca, a Colgate Total 12.
A empresa anunciou uma mudança na fórmula e no nome. A entidade ainda não se pronunciou sobre o assunto.
A Agência Nacional de Vigilância Sanitária (Anvisa) emitiu um alerta sobre os riscos de procedimentos com injeção de toxina botulínica, conhecido e denominado popularmente como botox. O aviso serve tanto para fins terapêuticos quanto estéticos. O aviso é direcionado para profissionais de saúde e para pacientes envolvidos na aplicação da toxina.
A entidade chamou atenção para a necessidade de que os procedimentos sejam realizados por profissionais habilitados, em locais autorizados pela vigilância sanitária, e que os medicamentos utilizados estejam registrados na Anvisa, seguindo as especificações da bula.
A medida chega após agência receber duas notificações de casos de botulismo associados à administração de toxina botulínica. Por meio de uma nota, a Anvisa explicou que durante uma revisão de dados de notificações e textos de bula disponíveis em outros países, foi solicitado que as empresas com produtos registrados com toxina botulínica acrescentem em bula o risco de que a toxina pode afetar áreas distantes do local da injeção.
De acordo com a agência, o ato pode causar sintomas graves de botulismo, que podem surgir horas ou semanas após a aplicação.
Os sintomas de botulismo citados foram visão borrada, pálpebras caídas, fala arrastada e dificuldade para engolir e respirar. Já em situações casos a enfermidade pode acarretar paralisia muscular generalizada e até morte.
A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu 47 pomadas para fixar ou modelar cabelos, nesta segunda-feira (24). Segundo o órgão, a iniciativa faz parte de uma ação para garantir produtos seguros. A medida tem vigência imediata e não podem ser comercializados.
De acordo com a entidade, a decisão é vista para fortalecer ações de verificação da regularidade de pomadas para fixar ou modelar cabelos.
Os produtos foram proibidos por falta de adequação às exigências da norma atual, a resolução 814, de 2023. Essas marcas não teriam apresentado uma série de obrigações do Sistema de Automação de Registro de Produtos de Higiene Pessoal, Cosméticos e Perfumes. Entre as determinações, está a declaração da empresa titular que atesta a segurança do produto, conforme a Anvisa.
A agência disse que o uso de pomadas irregulares ou inadequadamente pode causar efeitos como cegueira temporária (perda temporária da visão), forte ardência nos olhos, lacrimejamento intenso, coceira, vermelhidão, inchaço ocular e dor de cabeça.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou a suspensão imediata do atendimento em oito serviços de estética e embelezamento em Belo Horizonte (3 estabelecimentos), Brasília (1), Goiânia (1) e no estado de São Paulo (3). A decisão foi tomada após vistorias que identificaram “irregularidades graves que não podem ser sanadas a curto prazo ou de maneira simples”.
As inspeções ocorreram em 31 estabelecimentos, sendo que apenas uma unidade em Goiânia não apresentou problemas.
Nos demais locais, a Anvisa detectou uma série de falhas, como a ausência de boas práticas de funcionamento, falta de procedimentos e protocolos para a segurança dos pacientes, inexistência de prontuários, descarte incorreto de seringas, uso de produtos vencidos, aplicação de cosméticos injetáveis proibidos, além de problemas estruturais, como mofo e infiltração. A agência também constatou a falta de pias e dispensadores de álcool para higiene das mãos, além de falhas na limpeza e esterilização de equipamentos.
A Anvisa não divulgou os nomes das unidades interditadas, mas informou que a escolha dos estabelecimentos para vistoria foi baseada em denúncias de usuários e no alto volume de propagandas patrocinadas pelas marcas em mídias tradicionais e redes sociais. A operação, batizada de “Estética com Segurança”, foi realizada em parceria com as vigilâncias sanitárias estaduais e municipais e também incluiu a fiscalização de fornecedores de dispositivos médicos para procedimentos estéticos nas regiões Sul e Centro-Oeste.
A agência ressaltou que processos administrativos sanitários serão abertos para apuração e aplicação de penalidades aos estabelecimentos irregulares. Em seu site, a Anvisa disponibiliza orientações e cuidados que devem ser observados em tratamentos estéticos, reforçando a importância de segurança e responsabilidade nesses procedimentos.
A medida visa proteger a saúde dos consumidores e coibir práticas inadequadas no setor de estética, que tem crescido significativamente nos últimos anos. A Anvisa alerta que os usuários devem sempre verificar a regularidade dos estabelecimentos e a qualificação dos profissionais antes de realizar qualquer procedimento.
O Supremo Tribunal Federal (STF) autorizou desembargadores e juízes a concederem o medicamento Elevidys, avaliado em R$ 17 milhões, para pacientes com Distrofia Muscular de Duchenne. Muitos pacientes têm recorrido ao Judiciário para obrigar o Sistema Único de Saúde (SUS) ou os planos de saúde a custear o tratamento.
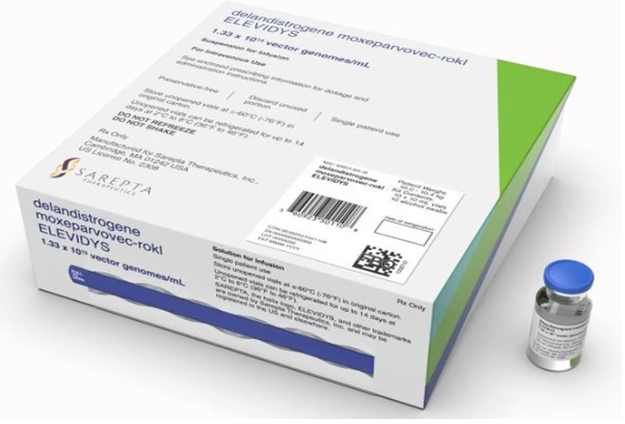
A decisão do STF estabelece condições rigorosas para a concessão do medicamento, como: o paciente deve apresentar capacidade de deambulação; a realização de testes genéticos que comprovem a ausência de deleção dos EXONS 8/9; estar dentro da faixa etária aprovada pela Agência Nacional de Vigilância Sanitária (Anvisa); apresentar títulos de anticorpos de ligação total anti-AAVrh74 abaixo de 1:400. Além disso, a concessão está restrita aos termos do registro aprovado pela Anvisa.
A autorização ocorre após a revogação de uma decisão que desobrigava o governo federal de adquirir o Elevidys, considerado um dos medicamentos mais caros do mundo. Essa mudança decorre de um acordo homologado entre a União e a farmacêutica Roche Brasil, que prevê o cumprimento de decisões judiciais que obrigam o fornecimento do medicamento.
Conforme o acordo, a União terá um prazo de 90 dias para realizar os trâmites administrativos necessários para o fornecimento do Elevidys.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta sexta-feira (22) a atualização da composição de duas vacinas utilizadas para a prevenção da covid-19 no Brasil. Serão modificadas a Spikevax, da farmacêutica Adium, e Comirnaty, da Pfizer.
Segundo a Anvisa, a atualização dos componentes consiste na alteração da cepa usada na produção do imunizante, atendendo a normas recém-publicadas pela própria agência. Segundo a Agência Brasil, as doses devem ser atualizadas periodicamente, de modo a conter as cepas recomendadas pela Organização Mundial da Saúde (OMS), como já acontece com a composição da vacina contra a influenza.
A recomendação vem da Organização Mundial de Saúde (OMS), que trabalha no monitoramento das variantes do vírus da covid em circulação no mundo. A organização atua ainda na verificação da eficácia das vacinas disponíveis. “Sua última recomendação foi publicada em 26 de abril deste ano, quando informou sobre a necessidade de atualização dos imunizantes para a cepa JN.1”, alegou a Anvisa, em nota.
Conforme a Anvisa, entre as três vacinas monovalentes aprovadas para a prevenção da covid-19 no Brasil, apenas a Spikevax e a Comirnaty solicitaram a atualização à entidade.
“Em setembro deste ano, a Anvisa priorizou a análise de dados e provas apresentados pelas empresas, por se tratar de imunizantes previstos no Programa Nacional de Imunizações (PNI) do Ministério da Saúde.”, escreveu o órgão. As informações são da Agência Brasil.
A Diretoria Colegiada (Dicol) da Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, na última quarta-feira (30), novos alertas e advertência sobre o consumo de cigarros nas embalagens dos produtos.
A nova medida trata de novas imagens e mensagens de advertência para embalagens, expositores e mostruários de cigarros e outros produtos derivados do tabaco.
Os alertas são obrigatórios no país, através de lei no Brasil, desde 1996 como uma medida para reduzir o tabagismo. As empresas terão um período de 12 meses para se adequarem ao novo padrão. O novo formato abriga 7 imagens e textos sobre os problemas à saúde causados pelo tabagismo, a exemplo da cegueira, câncer de pulmão e envelhecimento precoce.
As medidas serão obrigatórias a partir de 2 de novembro de 2025. De acordo com a agência, produtos que não seguirem as regras podem ser retirados de pontos de venda. O novo modelo de advertências sanitárias dos cigarros tem validade de 3 anos e vai se aplicar aos itens produzidos até novembro de 2027. Já em 2026, até o mês novembro, a Anvisa determinará uma nova regra para o período de 3 anos subsequente.
A diretoria colegiada da Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, nesta quarta-feira (30), a medida que permite a regularização de produtos à base de Cannabis e a prescrição desses produtos por médicos veterinários para animais.
De acordo com a Anvisa, a determinação vai possibilitar que veterinários habilitados pelo Conselho Federal de Medicina Veterinária (CFMV) possam transcrever medicamentos à base de Cannabis registrados pela Anvisa, ou seja, registrados como medicamentos.
A agência explicou ainda que vai acrescentar novos adendos que controlem substâncias e medicamentos especiais. “Todos os controles rígidos continuarão em vigor, garantindo o uso seguro e terapêutico desses produtos”, explicou o órgão.
Segundo a medida, os veterinários só poderão prescrever esses produtos em receitas especiais a serem retidas nas farmácias, forma semelhante de medicamentos e produtos controlados.
A mudança será oficializada no Diário Oficial da União, nos próximos dias.
A Agência Nacional de Vigilância Sanitária (Anvisa) solicitou informações às autoridades de saúde do Rio de Janeiro para monitorar o caso de falsificação de ozempic. A medida chega após uma mulher de 46 anos ter sido internada por usar medicamento falsificado.
Na última semana, a mulher ficou internada em estado grave após aplicar um produto que pensava ser o Ozempic, remédio aprovado para diabetes tipo 2 e utilizado de forma off-label para perda de peso, segundo a publicação. A paciente teria explicado que realizou o tratamento regular com o remédio, indicado por um endocrinologista. Ela teria comprado a caneta injetável em uma farmácia.
Somente após uma médica ter atendido a mulher na emergência da unidade de saúde, que desconfiou que o produto utilizado poderia não ter sido ozempic original. A paciente chegou ao hospital com um quadro grave de hipoglicemia – níveis baixos de açúcar no sangue.
O caso foi relatado à empresa responsável pelo medicamento, a farmacêutica Novo Nordisk. A Anvisa já emitiu três alertas sobre a identificação de lotes falsificados no país após receber informações do laboratório que monitora possíveis falsificações.
Em nota enviada ao GLOBO, a agência informou que vai analisar a necessidade de medidas adicionais acerca do caso.
A Sociedade Brasileira de Hepatologia (SBH) manifestou apoio à proibição dos chamados chips da beleza, implantes hormonais que utilizam esteroides anabolizantes, a ação é marco no cenário nacional.
Juntamente com 18 outras entidades médicas, a SBH enviou uma carta à Anvisa (Agência Nacional de Vigilância Sanitária) solicitando a suspensão da fabricação, distribuição e propaganda desses produtos. A informação é do Metro 1.
O documento expressa preocupação com a crescente utilização inadequada dos implantes hormonais no Brasil, destacando a falta de respaldo ético e científico das substâncias.
A Agência Nacional de Vigilância Sanitária (Anvisa) prorrogou a resolução que proíbe a comercialização e uso de produtos à base de fenol em procedimentos estéticos e de saúde em geral. A medida preventiva possui prazo indeterminado. A resolução foi publicada no Diário Oficial da União (DOU) nesta sexta-feira (27).
A Anvisa também manteve a proibição a importação, fabricação, manipulação e propaganda de produtos à base de fenol.O texto foi assinado por Marcus Aurélio Miranda de Araújo, gerente-geral de inspeção e fiscalização sanitária da entidade.
A proibição não inclui a exploração da substância para produtos devidamente regularizados juntos à Anvisa "nas exatas condições de registro". Também é permitido os produtos à base de fenol usados em laboratórios analíticos ou de análises clínicas.
Em nota, a Anvisa argumentou que a medida ocorreu por "preocupações com os impactos negativos decorrentes do uso de produtos não regularizados obtidos com o fenol na saúde das pessoas".
Em decisão de 2021, o órgão já havia estabelecido a proibição do uso do fenol em produtos cosméticos, perfumes e de higiene pessoal.
PRODUTOS AUTORIZADOS
A Anvisa também divulgou uma lista dos produtos que possuem a substância fenol, mas que não estão proibidos. Até o momento, estão regularizados na Agência os seguintes produtos, que possuem a substância fenol em sua formulação:
- Dordente - Hearst Laboratórios - Anestésico local
- Auris-Sedina - Laboratórios Osório de Moraes - Removedores de secreção do conduto auditivo externo
- Pomada de Erva de Bicho, Adrenalina e Hamamélis Composta Imescard - Laboratórios Osório de Moraes - Anti-hemorroidarios tópicos
- Syrex - FDA Allergenic Farmacêutica - Diluentes e veículos de medicamentos
- Paramonoclorofenol canforado - Maquira Indústria de Produtos Odontológicos Antisséptico e analgésico (curativo de demora)
- Paramonoclorofenol canforado - Lucipharma Indústria Farmacêutica - Antisséptico e analgésico (curativo de demora)
- Fenóis - Far Diagnostics - Kit para determinação quantitativa in vitro de compostos fenólicos em urina
- Paramonoclorofenol - Biodinâmica Química e Farmacêutica - Material intracanal. Ação bactericida
A Agência Nacional de Vigilância Sanitária (Anvisa) emitiu um alerta sobre o uso seguro de fórmulas infantis. Na lista de recomendações aparece o item de que os consumidores evitem comprar fórmulas infantis importadas por meio de comércio eletrônico, por conta das dificuldades para saber a origem e a regularização do produto.
É importante lembrar que fórmulas infantis são produtos, em forma líquida ou em pó, fabricados especialmente para satisfazer as necessidades nutricionais de públicos específicos. Segundo a legislação, os produtos necessitam ter registro na Anvisa, e devem ser utilizados somente após prescrição de um profissional de saúde habilitado, como médico pediatra ou nutricionista.
As fórmulas infantis são classificadas como alimentos destinados à alimentação de lactentes (0 a 6 meses de idade) e/ou de seguimento para lactentes (6 a 12 meses de idade) e/ou crianças de primeira infância (1 a 3 anos de idade).
De acordo com a Agência Brasil, essas fórmulas precisam de registro na Anvisa antes da sua importação, fabricação, comercialização ou dispensação.
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou nesta terça-feira (24) uma resolução que proíbe a venda de duas marcas de azeite: a Serrano e Cordilheira. Segundo o órgão, os produtos das marcas importadas estavam sendo distribuídos irregularmente por empresas desconhecidas no Brasil, sem garantias de segurança e qualidade.
A proibição inclui não só a venda, mas também a fabricação, propaganda e uso desses produtos. Na mesma resolução, a Anvisa também suspendeu a comercialização e recolheu o lote 030424158 de coco ralado da marca Coco & Cia. As informações são do g1.
O texto publicado no Oficial da União explica que o motivo foi um resultado insatisfatório em testes que detectaram a presença de dióxido de enxofre acima do permitido no lote. A Anvisa determinou a retirada do produto do mercado e proibiu sua distribuição, propaganda e uso.
As três empresas envolvidas não se pronunciaram sobre o caso, até o momento.
Um levantamento produzido pela plataforma de combate à piratia “ Offer” encomendado pela Philip Morris Brasil identificou 11.594 anúncios ilegais dos cigarros eletrônicos (vapes) no país. Os falsos anúncios foram encontrados em redes sociais, sites privados e até em plataformas de entrega.
De acordo com a pesquisa, via Metrópoles, os pagamentos são realizados, em sua maioria, por meio de Pix, e as entregas são realizadas após algumas horas. No entanto, a comercialização e a publicidade dos dispositivos eletrônicos para fumar são proibidas no Brasil desde 2009.
O estudo chega durante os debates entre a Receita Federal e a Anvisa sobre a restrição dos produtos no país. O Ministério da Saúde e a Anvisa ainda não se pronunciaram sobre a descoberta feita pela pesquisa.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou - por unanimidade - uma instrução normativa que autoriza a atualização da composição de vacinas contra a covid-19. A medida é adotada para evitar o aumento da circulação de novas variantes do vírus SARS-CoV-2 pelo país.
A relatora da matéria, a diretora Meiruze Sousa Freitas, informa que a evolução constante do SARS-CoV-2 exige que as vacinas sejam atualizadas periodicamente. “O aprendizado que tivemos com a pandemia trouxe à tona a necessidade de respostas regulatórias mais ágeis. Para reduzirmos a chance de danos, é preciso reduzirmos lacunas no arcabouço regulatório. Elas precisam ser ajustadas em tempo real para atendermos as demandas urgentes de uma crise sanitária”, argumentou Meiruze.
Segundo a Agência Brasil, a proposta normativa inclui a resolução da diretoria colegiada e a instrução normativa que tratam das atualizações das vacinas, estabelecendo, segundo ela, “critérios claros e eficientes para atualização das vacinas no Brasil, de forma alinhada com as diretrizes internacionais e a evolução do cenário epidemiológico”.
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou através de uma resolução da diretoria colegiada nova regulamentação de boas práticas para as empresas fabricantes de cosméticos. O intuito da medida é assegurar o monitoramento e a segurança dos cosméticos que são autorizados no Brasil, para averiguar eventuais riscos à saúde e que caso os problemas aconteçam sejam gerenciados de forma eficaz e em tempo hábil.
A decisão, que entra em vigor em doze meses, visa ainda gerenciar de forma eficaz e em tempo hábil possíveis problemas de saúde causados por cosméticos. A ação utiliza o termo cosmetovigilância, usado para designar a vigilância e o monitoramento pós-comercialização (quando o produto chega às mãos dos consumidores) e pós-uso (após utilização pelos clientes).
Segundo publicação da Agência Brasil, a iniciativa vai contemplar as atividades de identificação, notificação, avaliação, investigação, monitoramento, comunicação e prevenção de reações adversas decorrentes do uso de produtos cosméticos em condições normais ou razoavelmente previsíveis.
Entre os principais pontos estão a definição clara das responsabilidades das empresas de cosméticos; estabelecimento de um sistema de cosmetovigilância robusto, composto por pelo menos seis requisitos mínimos obrigatórios: coleta, avaliação, investigação e notificação de eventos graves.
Cada organização deverá indicar um profissional que será responsável pelo prazo de notificação à Anvisa será definido; além da definição e implantação de medidas para reduzir riscos pelas empresas quando identificados problemas de segurança com os produtos cosméticos produzidos.
Curtas do Poder
Pérolas do Dia
Jojo Todynho
"Eu não tenho pretensão política nenhuma".
Disse a cantora Jojo Todynho ao comentar o cenário político atual e opinar sobre o desfecho eleitoral do país.